2025年3月Cell期刊精华
来源:生物谷原创 2025-04-01 10:00
2025年3月份即将结束,3月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.生命起源的“惊人发现”Cell:新研究发现阿斯加德古菌除了具有肌动蛋白丝外,还具有微管
doi:10.1016/j.cell.2025.02.027
十年前,科学家们还不知晓阿斯加德古菌(Asgard archaea)的存在。直到2015年,深海沉积物中的神秘基因片段被拼凑成完整的基因组,一个全新的微生物世界才浮出水面。这些单细胞生物不仅是古菌家族的新成员,更可能是连接古菌与真核生物(如动植物)的“缺失环节”——它们携带的细胞骨架基因,正在改写我们对生命起源的认知。
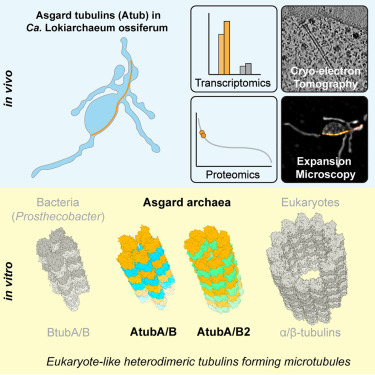
苏黎世联邦理工学院的Martin Pilhofer团队在《Cell》发表的最新研究显示,阿斯加德古菌甚至拥有类似真核生物的微管结构。这种由微管蛋白(tubulin)组成的管状支架,此前被认为是真核生物独有的“运输轨道”,用于细胞内物质运输和染色体分离。然而,阿斯加德古菌的微管虽比真核生物的更细小,却能以相似的方式生长,暗示着两者在进化上的深层联系。
在一项新的研究中,Pilhofer团队发现了阿斯加德古菌具有微管,并描述了它们的结构。这些实验表明,阿斯加德古菌的微管蛋白形成非常相似的微管,尽管比它们的真核生物亲属中的微管小。相关研究结果发表在Cell杂志上。
2.Cell:首次利用cryo-ET揭示揭示逆转录转座子copia的三维结构
doi:10.1016/j.cell.2025.02.003
一场军备竞赛正在我们的细胞中展开:转座子,也称为跳跃基因或可移动的遗传因子,可以复制并重新插入基因组,通过触发DNA重排和引起突变来威胁细胞的基因组完整性,反过来,宿主细胞利用阻止转座子跳跃的复杂防御机制来保护其基因组。
如今,来自马克斯-普朗克生物化学研究所、马克斯-普朗克生物物理学研究所和奥地利科学院分子生物技术研究所的研究人员通过改进低温电子断层扫描(cryo-ET)技术,首次以亚纳米分辨率对黑腹果蝇卵室中的逆转录转座子copia进行了成像。相关研究结果发表在《细胞》杂志上。
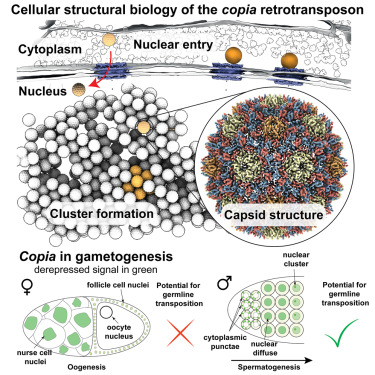
在这项新的研究中,研究人员采用了cryo-lift-out技术,该技术允许通过在低温下结合聚焦离子束和先进的微操纵技术,为cryo-ET制备复杂组织。他们利用黑腹果蝇的卵室和从中分离出的细胞,在7.7Å的分辨率下解析逆转录转座子copia衣壳的结构,这是在天然细胞环境中解析出的第一个亚纳米分辨率的逆转录转座子结构。
利用基于人工智能的结构预测的最新进展,该团队使用AlphaFold 2生成了衣壳组装的综合模型,使他们能够随后设计结构引导实验。通过这一点,他们能够证明copia逆转录转座子采用了与HIV-1成熟衣壳相似的衣壳折叠,证实了之前对纯化样品中转座子结构的观察。
3.Cell:利用Perturb-FISH研究基因和遗传回路在组织发育、稳态和功能障碍中的作用
doi:10.1016/j.cell.2025.02.012
最近,科学家们已经能够使用抑制特定基因的方法探索单个细胞中的基因回路,并测量对其他基因表达的影响。然而,这些方法未能捕捉到对邻近细胞的影响等空间信息,而这些信息可以为细胞或基因在健康和疾病中的作用提供重要线索。
如今,在一项新的研究中,来自布罗德研究所空间技术平台的研究人员开发的一项技术以这些方法为基础,取得了前沿的空间进步。他们的方法被称为Perturb-FISH,将基于成像的空间转录组测量与CRISPR向导RNA的大规模检测相结合。
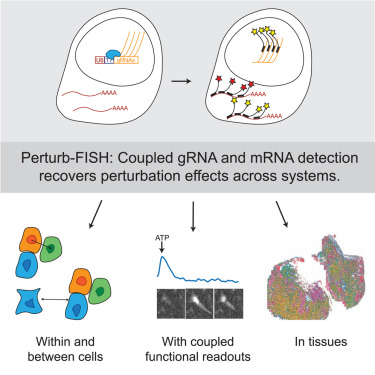
研究人员证实Perturb-seq能够揭示新的细胞和功能见解,包括自闭症相关基因对细胞活性的影响以及动物模型中人类肿瘤细胞和免疫细胞之间的相互作用。对Perturb-FISH的进一步改进可能使其更广泛地使用,并实现一系列新的生物研究。相关研究结果发表在Cell杂志上。
论文共同通讯作者、布罗德研究所空间技术平台主任Sami Farhi说,“通过Perturb-FISH,我们开发了一种强大的新方法来研究基因和遗传回路在组织发育、稳态和功能障碍中的作用。我们的团队致力于为科学界的利益设计空间工具,我们希望这种新方法只是我们将建立和分享的更多方法中的第一种。”Farhi与论文共同通讯作者Brian Cleary一起领导了这项研究。
4.Cell:新研究揭示有丝分裂期间,细胞染色体形成DNA环机制
doi:10.1016/j.cell.2025.02.028
为了在细胞分裂过程中准备人类细胞的46条染色体分配到子细胞,每条染色体形成一个紧凑的有两个杆状拷贝的X形结构。细胞如何实现这一壮举在很大程度上仍然未知。
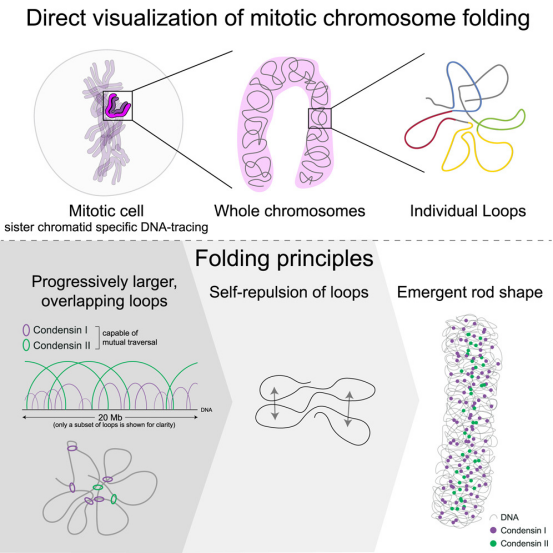
如今,在一项新的研究中,来自欧洲分子生物学实验室(EMBL)的研究人员首次使用一种新的染色质追踪方法在显微镜下以高分辨率直接观察到这一过程。这项研究发表在Cell杂志上。
这项新的研究表明,每条染色体的长DNA分子在细胞分裂过程中形成了一系列相互排斥的重叠环。由于这种排斥作用,这些DNA环然后堆叠形成杆状染色体。
5.肠道里的“压力传感器”Cell:新研究揭示压力感应蛋白PIEZO1驱动肠道蠕动机制
doi:10.1016/j.cell.2025.02.031
每顿饭后,肠道都会进行一种称为蠕动(peristalsis)的动作——通过平滑肌的协调收缩和放松,推动食物在消化道中行进。尽管一个多世纪前,科学家们已经知道是肠道中的神经细胞推动结肠移动,但它们具体如何工作却始终是个谜。
如今,由来自哈佛医学院和西奈山伊坎医学院的研究人员领导的一项新研究确定了这一现象背后的机制,表明肠道的蠕动会因锻炼、压力和炎症而改变。相关研究发表在Cell杂志上。
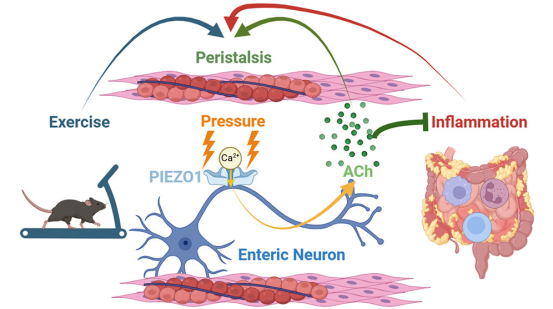
研究还发现,PIEZO1与炎症性肠病(IBD)密切相关。在IBD小鼠模型中,PIEZO1活跃的小鼠肠道蠕动加快,试图通过加速排泄来对抗炎症。然而,当科学家关闭PIEZO1时,小鼠不仅消化变慢,肠道炎症反而加剧——保护性的黏液层变薄,炎症细胞大量入侵。
原来,PIEZO1的激活会促使肠道神经释放乙酰胆碱(acetylcholine),这种化学物质不仅能指挥肌肉收缩,还能像“消防员”一样抑制炎症。论文共同通讯作者Ruaidhrí Jackson打了个比方:“乙酰胆碱是肠道里的‘双面特工’,一边指挥肌肉跳舞,一边悄悄灭火(炎症)。而PIEZO1就是启动这位特工的‘开关’。”
6.Cell:意外!科学家发现雌性小鼠肠道在怀孕期间会变长!
doi:10.1016/j.cell.2025.02.015
许多雌性动物的器官会因繁殖而重塑,但肠道对怀孕反应背后的内在机制直到最近才开始被深入研究。例如,科学家们之前发现果蝇的肠道在繁殖过程中会扩张。
现在,一项由弗朗西斯-克里克研究所的研究人员发表在《Cell》杂志上的研究揭示了一个令人惊讶的现象:小鼠的小肠在怀孕期间会显著增长,这种变化甚至在哺乳期结束后仍然存在,为第二次怀孕做好了准备。
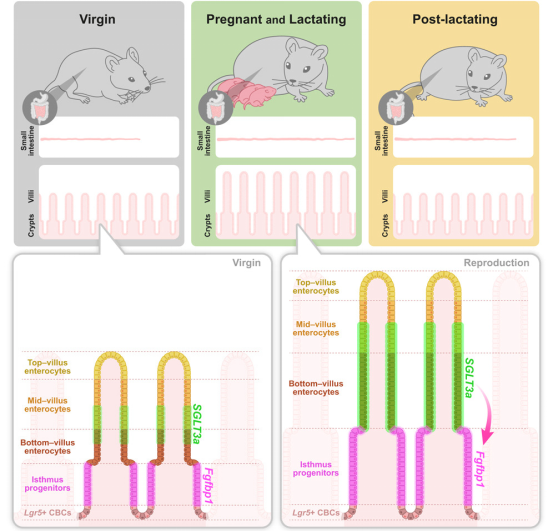
研究发现,怀孕的小鼠从怀孕第七天起,小肠就开始变长。到怀孕结束时(大约第18天),小肠延长了18%。有趣的是,这种变化在哺乳期结束后仍然持续,甚至在断奶后长达35天,这表明这种变化是部分不可逆的。此外,第二次怀孕后的小肠比第一次怀孕后更长。
在小肠内部,绒毛(负责吸收营养的突起)和隐窝(产生绒毛细胞的地方)也随着肠道的延长而变长变深。然而,这些结构在断奶后仅7天就恢复到怀孕前的状态。研究人员推测,较长的小肠和绒毛可能有助于增加妊娠期间母体和后代所需的营养摄入。
7.Cell:新研究构建出大脑等组织中迄今为止最完整的蛋白周转图谱
doi:10.1016/j.cell.2025.02.021
在一项新的研究中,来自哥廷根大学医学中心等研究机构的研究人员绘制了迄今为止最完整的不同蛋白质在身体许多组织中持续存在多长时间的图谱。他们能够确定一种增加蛋白质稳定性从而有利于阿尔茨海默病和帕金森病等神经退行性疾病的机制。研究结果发表在Cell杂志上。
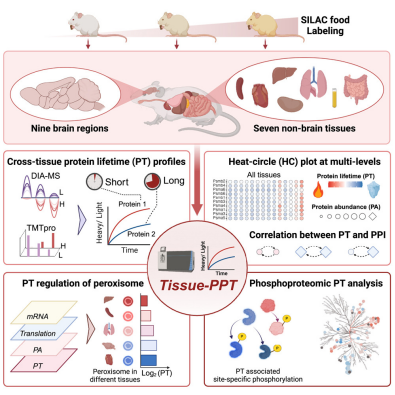
在这项新的研究中,哥廷根大学医学中心神经与感觉生理学系组长Eugenio F.Fornasiero博士及其来自耶鲁大学和圣犹达儿童研究医院的同事们绘制了迄今为止最完整的不同蛋白质在身体许多组织中持续多久的图谱。
研究人员发现,一种将蛋白质“开启”和“关闭”的机制——蛋白质磷酸化,也在蛋白质的稳定中发挥作用。在这个过程中,磷酸基团转移到蛋白质上,导致相应的蛋白质被激活。去除磷酸基团会关闭蛋白质。例如,在患有阿尔茨海默病的小鼠的脑组织中,他们能够证明参与疾病发展的蛋白质“Tau”在某些部位越来越磷酸化。这增加了Tau蛋白的稳定性并延长了其寿命。这反过来又促进了蛋白质聚集物的形成和神经细胞的死亡。
8.Cell:增强脑膜淋巴管功能的疗法有望改善年老哺乳动物的记忆力
doi:10.1016/j.cell.2025.02.022
随着衰老身体的功能下降,大脑失去了清除废物的能力,科学家们认为这种情况可能会导致阿尔茨海默病和帕金森病等神经退行性疾病。
如今,来自华盛顿大学医学院的研究人员报告说,他们找到了一种解决这个问题的方法,即靶向从大脑中排出废物的淋巴管网络。他们证实让这些淋巴管恢复青春可以提高老年小鼠的记忆力。这一发现为开发与年龄相关的认知能力下降的疗法奠定了基础,这也有助于克服传统药物难以通过血脑屏障到达大脑所面临的挑战。相关研究结果发表在Cell杂志上。

论文共同通讯作者、华盛顿大学医学院病理学与免疫学教授Jonathan Kipnis博士说,“血脑屏障阻碍了神经系统疾病疗法的疗效。通过靶向对大脑健康至关重要的大脑外淋巴管网络,我们看到小鼠的认知能力得到了改善,为开发更有效的疗法以预防或延缓认知能力下降打开了一扇窗户。”
当脑膜淋巴管系统受损以至于大脑中积聚废物时,清洁的负担落在了大脑中驻留的称为小胶质细胞的免疫细胞上。但Kipnis解释说,大脑中存在的小胶质细胞无法跟上混乱的局面,筋疲力尽。
这项新研究发现,不堪重负的小胶质细胞会产生一种遇险信号,一种称为IL-6的免疫蛋白,它作用于脑细胞,促进淋巴管受损小鼠的认知能力下降。研究人员研究了这些小鼠的大脑,发现神经元从周围脑细胞接收的信号类型不平衡。
特别是,在神经元通信的杂音中,神经元接收到的信号较少,这些信号的功能类似于降噪耳机。这种不平衡是由大脑中IL-6水平升高引起的,导致大脑连接方式的变化,并影响正常的大脑功能。
doi:10.1016/j.cell.2025.02.006
如今,在一项发表在Cell杂志上的新研究中,来自马萨诸塞大学医学院和昆士兰大学的研究人员探究了考拉逆转录病毒(koala retrovirus, KoRV-A)如何在澳大利亚昆士兰州的野生考拉种群中传播,解释了这些动物如何通过关闭或沉默KoRV-A来适应针对它的基因组免疫,毕竟它成为考拉基因组的一个组成部分。这有助于更好地了解考拉基因组的进化。这很重要,因为大多数野生考拉天生就携带KoRV-A作为其遗传物质的一部分。
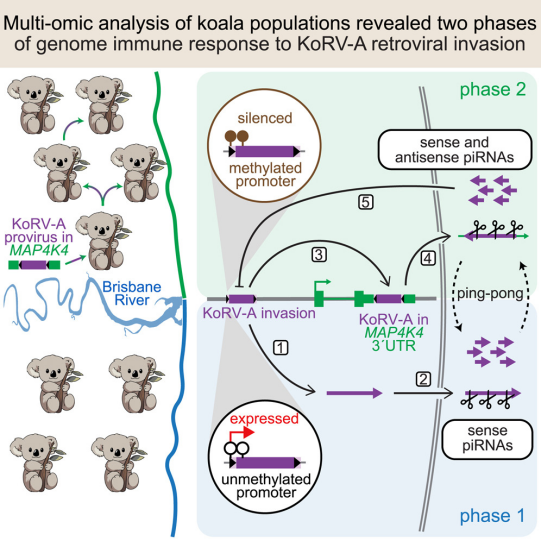
KoRV-A通过感染产生卵子和精子的生殖细胞在野生考拉之间传播,抑制免疫系统,使得这些动物容易患上癌症和继发性衣原体感染。
研究人员报告称,KoRV-A的一个拷贝被宿主基因捕获,生殖细胞将这个经过修饰的基因的产物加工成小片段的“抗KoRV-a”RNA,即piRNA。在piRNA中捕获的病毒序列用于在宿主基因组中找到KoRV-A的拷贝,并将其关闭。
论文共同通讯作者、马萨诸塞大学医学院分子医学教授William E.Theurkauf博士说,“这种病毒首先感染了澳大利亚北部的考拉,并在感染生殖细胞的同时向南传播,成为基因组的一个组成部分。从北到南的传播使我们能够观察生殖细胞如何学习控制一种全新的感染。”
10.脑机接口新突破!Cell:瘫痪男子用“意念”操控机械臂,持续七个月无障碍!
doi:10.1016/j.cell.2025.02.001
想象一下,仅仅通过“想”就能控制机械臂完成抓取、移动和放下物体的动作——这听起来像是科幻电影中的情节,但如今,加州大学旧金山分校的科学家们已经将这一梦想变成了现实。
在一项发表于《Cell》杂志的研究中,研究人员通过一种称为脑机接口(brain-computer interface, BCI)的设备,成功帮助一名瘫痪男子实现了对机械臂的精准控制,而且这种设备在不需要频繁调整的情况下,稳定工作了创纪录的七个月!
脑机接口并不是一个全新的概念,但以往的设备通常只能工作一两天,随后就需要重新校准。这项新研究的突破在于,它结合了一种人工智能(AI)模型,能够适应大脑活动的微小变化,从而长期稳定地工作。

这项研究的参与者是一名几年前因中风而瘫痪的男子,他无法说话或移动。研究团队在他的大脑表面植入了微型传感器,用于检测他想象移动时的大脑活动。尽管他无法真正移动身体,但当他想象自己在做动作时,大脑仍然会产生相应的信号。
Ganguly团队发现,尽管大脑中表示特定动作的模式形状保持不变,但它们的位置每天会略有变化。通过让人工智能模型学习这些变化,研究人员成功让设备在几个月内稳定运行,而不需要频繁调整。
为了让参与者更好地控制机械臂,研究人员首先让他在虚拟环境中练习。通过虚拟机器人手臂的反馈,他逐渐掌握了如何通过“意念”精准控制动作。随后,他将这种技能转移到了真实的机器人手臂上。
经过一段时间的练习,这名参与者不仅能够用机械臂捡起积木、转动并移动它们,还能完成更复杂的任务,比如打开橱柜、取出杯子并将其举到饮水机前。几个月后,他仍然能够在短短15分钟的“调整”后,继续控制机械臂。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


